Introduction
C'est la substance quantitativement la plus importante.
- Homme = 63%
- Champignon = 83%
- Méduse = 98%
- Poumon = 70% / Os ˜ 0%
La dessiccation entraîne des maladies graves allant de la crampe à la mort.
Les propriétés de l'eau s'expliquent grâce à sa structure.
I. La structure de l'eau
I.A. La molécule d'eau H2O
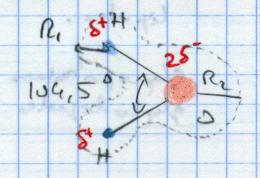 |
Rayon = limite où les forces d'attraction entre molécules sont compensées par les forces de répulsion (nuage électronique). L'eau est une molécule polarisée. O → 6 e-. Si la couche 2 > 4 e- → capture des e- alors que si la couche 2 < 4 e- → tendance à perdre des e-. Donc l'oxygène est électronégatif. Dans l'eau, les molécules sont proches. |
I.B. Les liaisons entre molécule d'eau : liaison hydrogène
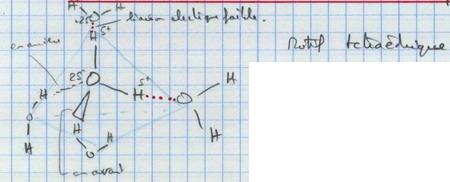
La liaison hydrogène est une liaison électrostatique faible. Sa longueur est de 0,177 nm.
O - H est une liaison covalente.
L'énergie de liaison pour une liaison hydrogène est de 18,8 kJmol-1
L'énergie de liaison pour une liaison covalente O - H est de 460 kJmol-1 (25 fois plus)
Remarque : Les liaisons hydrogènes ne sont pas spécifiques à l'eau. Il y aura des liaisons hydrogène chaque fois qu'une molécule sera polaire.
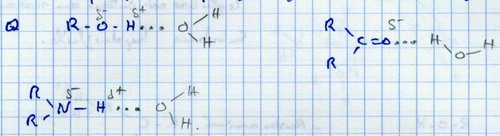
I.C. Les différents états de l'eau

II. Propriétés résultant de la structure
II.A. Particularités physiques
Point de fusion = 0°C
Point d'ébullition = 100°C
Tension superficielle élevée
Ces valeurs sont élevée par rapport à des molécules semblables mais non polarisées (H2S).
Fluidité élevée malgré liaisons hydrogène car la durée de vie de ces liaisons est très faible.
II.B. L'eau est un solvant polaire
(non polaire = benzène)
L'eau ne peut dissoudre que des molécules polaires ou des ions.
II.B.1. Solubilité des ions
Les ions sont solubles car chargés. Il y a création de liaisons électrostatiques. Les ions sont intégrés au réseau de l'eau : il s'agit d'une solution vraie. Mais désorganisation du réseau de l'eau, donc il existe une limite de saturation. Les ions modifient les propriétés de l'eau. Ils diminuent la T° de fusion, augmentent le T° d'ébullition et augmentent la pression osmotique. |
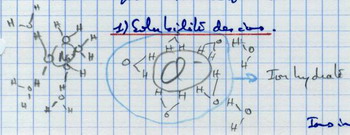 |
II.B.2. Solubilisation des molécules polaires
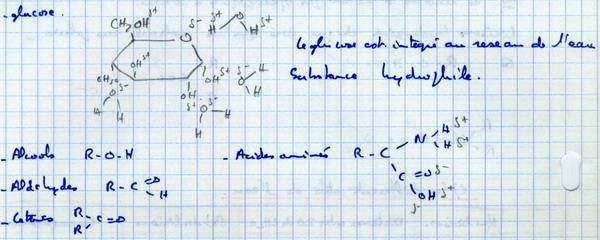
Le benzène est un solvant des lipides
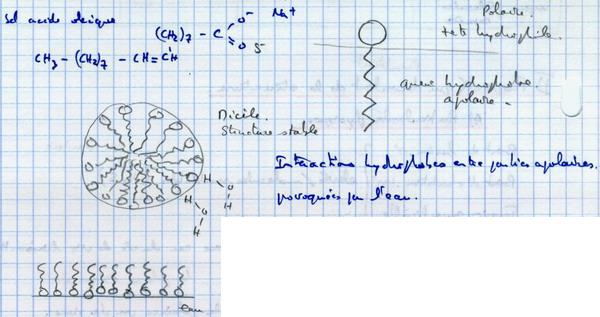
II.B.3. L'eau permet les interactions hydrophobes
II.C. L'eau peut s'ioniser
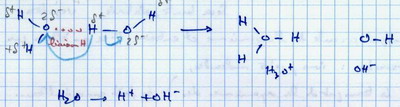
III. L'eau chez les êtres vivants
III.A. Ses différents états
III.A.1. L'eau libre
Eau de réserve que l'on peut perdre sans qu'il y ait de troubles.
III.A.2. L'eau métabolique
R - O - R' + H2O ↔ R - OH + R' - OH
L'hydrolyse consomme de l'eau, la synthèse libère de l'eau.
III.A.3. L'eau liée physiquement
C'est l'eau qui est liée aux colloïdes : molécules polaires qui fixent l'eau par liaison électrostatique. Il est difficile d'extraire l'eau des colloïdes.
III.A.4. L'eau liée chimiquement
- Fragments de molécules d'eau (H ou OH) rentrés dans d'autres molécules. Liaisons covalentes qu'on ne peut extraire par minéralisation.
- En utilisant H2O* → Tissu organique*
Formation d'eau à partir de molécules organiques
R - OH + R' - OH ↔ R - O - R' + H2O
III.B. Différents rôles de l'eau chez les êtres vivants
III.B.1. Rôle de solvant
L'eau dissous les ions, les substances polaires (petites molécules organiques), disperse les substances hydrophobes → augmente les surfaces réactionnelles.
III.B.2. Rôle de transport
C'est une conséquence du rôle de solvant.
Les grands liquides organiques sont :
- Le sang et la lymphe (animaux).
- La sève brute et la sève élaborée (végétaux)
L'eau circule dans l'organisme et tout ce qu'elle a pu dissoudre. Le transport des ions et petites molécules dans les organismes se fait grâce à l'eau. Il suffit de mettre l'eau en mouvement pour mettre en mouvement ces substances.
Chez la plante, ce sont les racines qui absorbent l'eau et les ions. Grâce à la transpiration foliaire, l'eau remonte dans la plante avec les ions.Conséquence de la cohésion des molécules d'eau : pouvoir d'entraîner par aspiration.
Chez les animaux, absorption intestinale de l'eau, des sels minéraux, des acides aminés, des oses vers le sang. Le cœur met le sang en mouvement : ravitaillement et nettoyage. Sang = liaison entre les organes.
III.B.3. Participation aux réactions métaboliques
Hydrolyse, oxydoréduction, extraction ou incorporation de molécules → nombreuses réactions cellulaires. Sans eau, pas de réactions chimiques possible. (exemple : graines déshydratées).
Eau = milieu réactionnel qui disperse les molécules en les solubilisant et permet les rencontres et les interactions entre les molécules.
III.B.4. Rôle dans la conformation des protéines
La conformation spatiale des protéines est particulière par rapport à la structure primaire (chaîne).
Pour être fonctionnelle, la chaîne se replie spécifiquement à cause des interactions avec l'eau → ramification, micelles. Les parties hydrophobes se replient à l'intérieur.
III.B.5. Rôle mécanique de l'eau
Surtout chez les cellules végétales : turgescence = pression sur la paroi rigide pectocellulosique → port dressé.
III.B.6. Rôle thermique de l'eau
III.B.6.a. Tampon thermique
L'eau possède une chaleur spécifique élevée. Il faut fournir une quantité importante de chaleur pour augmenter sa température et il faut qu'elle perde beaucoup de chaleur pour que sa température diminue. Permet de lutter contre le refroidissement rapide de l'atmosphère. Les organismes sont à l'abri des variations thermiques extérieures (organismes non homéothermes).
III.B.6.b. Rôle régulateur de la température corporelle
Du à la chaleur de vaporisation élevée. Il faut une très grande quantité de chaleur pour assurer le passage de l'état liquide à l'état de vapeur. Ce phénomène est utilisé par la transpiration. Si la T° corporelle augmente, transpiration → vaporisation de l'eau grâce au surplus d'énergie à la surface du corps → refroidit le corps. Ne marche que si l'atmosphère n'est pas saturée en vapeur d'eau.
Conclusion
Tous les aspects de la vie sont bien adaptés aux propriétés de l'eau. La vie est apparue dans l'eau → dépendance vis à vis de l'eau. Utilisation des propriétés du milieu environnant. Sortie des eaux → dépendance de l'eau.
Nécessité d'un flux hydrique permanent Absorption / Elimination. Les organismes les mieux adaptés au milieu aérien sont ceux qui utilisent le moins d'eau.
Cependant, une propriété reste mal adaptés à la vie : le point de fusion élevé (0°C). Inconvénient du gel.
Sujets :
- L'eau, solvant biologique.
- Rôle de l'eau dans la matière vivante.
- Rôle biologique de l'eau.
