Introduction
Ce sont les molécules organiques les plus importantes en masse. Dans la nature, une grande quantité est représentée par l’amidon, les parois cellulosiques des végétaux.
On distingue :
- Les glucides simples = oses = monosaccharides.
- Les osides = polycondensats d’oses (polycondensat = condensation et départ d’une molécule d’eau).
- Diholosides.
- Polyosides.
- Diholosides.
I. Les oses
I.A. Nomenclature utilisée
I.A.1. Terminologie utilisée
I.A.1.a. Par rapport à la fonction
Les oses sont des polyalcools -OH.
- Fonction aldéhyde en plus = Aldoses

Nomenclature se terminant par -ose
- Fonction cétone en plus = Cétone

Nomenclature se terminant par -ulose (exception : fructose → lévulose).
I.A.1.b. Par rapport au nombre de carbones
De 3 à 8 carbones :
C3 = triose (aldotrioses et cétotrioses)
C4 = Tetroses
C5 = Pentoses
C6 = Hexoses
C7 = Heptoses
C8 = Octoses
La formule générale est : (CH2O)n
I.A.2. Représentation simplifiée

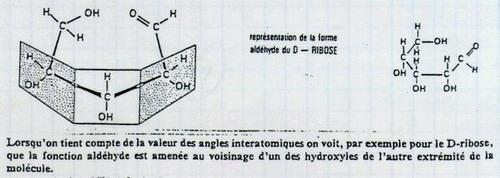

I.B. Stéréo-isomérie des oses
Isomérie = même structure de base mais structure moléculaire différente.
- Les isomères de constitution diffèrent par leur fonctions
- Les stéréo-isomères résultent de l’existence d’un carbone asymétrique
Exemple des hexoses C6H12O6
I.B.1. Isomères de constitution
- Aldohexoses = glucose
- Cétohexoses = fructose
I.B.2. Enantiomères D et L (isomères optiques)
 |
 |
Isomérie due à la présence d’un carbone asymétrique ou carbone chiral. Il existe alors deux modalités de regroupement différentes sur ce carbone. Ce deux conformations sont symétriques dans un miroir. Il en existe 4 dans les hexoaldoses et 3 dans les hexocétoses.
Dans la nature, on ne trouve pratiquement que des séries D. Les séries D et L ont des propriétés optiques différentes.
- (+) dextrogyre : possibilité de dévier la lumière polarisée vers la droite.
- (-) lévogyre : possibilité de dévier la lumière polarisée vers la gauche.
Il n’y a pas de relation avec la nomenclature D glucose ou L glucose (différents de dextrogyre et lévogyre).
I.B.3. Epimères ou isomères de position

I.B.4. Anomères
Ce sont des formes isomériques qui n’existent qu’à partir des pentoses.
I.B.4.a. Mise en évidence de deux nouveaux stéréo-isomères
(+)D glucose → 2 sous ensembles qui n’ont pas les mêmes propriétés optiques. Deux formes cristallisées différentes :
- (+) α D glucose → α D glucose + 112° de déviation
- (+) β D glucose → β D glucose + 18,7° de déviation
Il y a donc un nouveau carbone asymétrique. Mais quand on repasse la forme cristallisée en solution :
- α D glucose + 52,7° de déviation soit 2/3 α D
- β D glucose + 52,7° de déviation soit 1/3 β D
Il y a transformation de α en β et de β en α. C’est une mutarotation des sucres. Les deux formes sont inter convertibles.
I.B.4.b. Observation de caractéristiques réactionnelles inattendues
Les aldohexoses ne se comportent pas comme des aldéhydes ! Ils ne colorent pas la fushine de Schiff décolorée. De même, les cétohexoses n’ont pas les propriétés réactionnelles des cétones. Les fonctions aldéhydes et cétones ne sont pas réactives : elles sont cachées.
I.B.4.c. Interprétation : cyclisation de la molécule
Il y a un réarrangement moléculaire. Il y a création d’une nouvelle liaison intramoléculaire.
I.B.4.c.1. Cas des aldohexoses
Il y a deux possibilités différentes de cyclisation.

La forme pyranose est plus stable et plus fréquente pour les aldohexoses que la forme furanose. Les formes furanose et pyranose d’un sucre ne sont pas des isomères mais des conformations particulières de la molécule qui n’induisent pas de propriétés différentes. En solution, pour un ose donné, il y a équilibre entre les formes cyclisées et les formes linéaires.
formes cyclisées ↔ formes linéaires
I.B.4.c.2. Cas des cétohexoses
| Pas de forme pyranose. Exemple du D fructose |
 |
I.B.4.d. Représentations prospectives de Haworth

I.B.4.e. Conformation réelle des molécules

Ces deux formes sont inter convertibles, on peut passer de l’une à l’autre. La forme chaise est la plus stable.
En résumé :
Cas des hexoses C6H12O6
Quelle réalité moléculaire se cache derrière cette formule ?
I.C. Propriétés des oses
I.C.1. Propriétés physiques
| Grande solubilité due aux liaisons hydrogènes avec les molécules d’eau. Activité optique : déviation de la lumière polarisée. |
 |
I.C.2. Propriétés chimiques
- Propriétés réductrices
Les oses réduisent la liqueur de Felhing. La solution bleue donne un précipité rouge brique du au groupement OH en position 1
- Propriété de former des esters en particulier avec l’acide phosphorique
I.D. Les principaux oses de la matière vivante
Uniquement des oses de la série D. (glycéraldéhyde… voir poly). Les oses interviennent surtout dans le métabolisme énergétique.
Glucose : molécule substrat des oxydations cellulaires (cf. respiration et fermentation).
I.E. Principaux dérivés des oses
I.E.1. Polyalcools dérivés d'oses
| Fonction aldéhyde ou cétone réduite. |  |
I.E.2. Acides dérivés d'oses : acides uroniques
| Exemple : acide α D glucuronique. La fonction acide est portée par le dernier carbone. |  |
I.E.3. Les phosphates dérivés d'oses : esters phosphoriques d'oses

I.E.4. Les osamines
| Fonction amine sur le carbone n°2. |  |
I.E.5. Les Nglycosamines
| Fonction amine sur le carbone n°1. Exemple : N α D glucopyranose méthyl-amine. |
 |
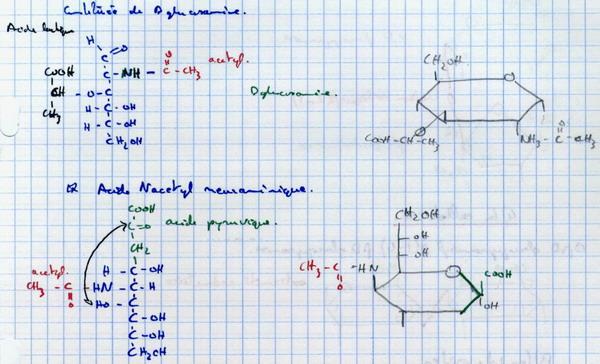
I.E.6. Acides muramiques et neuraminiques
Exemple : Acide N acétyl muramique.
II. Les osides
Ce sont des glucides constitués d’un enchaînement d’oses.
II.A. Les diholosides
Deux oses liés par la liaison osidique.
II.A.1. Le maltose
| O α D glucopyranosyl α(1-4) α D glucopyranose. C’est un sucre réducteur. |  |
II.A.2. Le lactose
| O α D galactopyranosyl α(1-4) α D glucopyranose. C’est un sucre réducteur. |  |
II.A.3. Le saccharose ou sucrose
| O β D fructofuranosyl (2-1) α D glucopyranose. C’est un sucre non réducteur. |  |
II.A.4. La cellobiose
| O β D glucopyranosyl β(1-4) β D glucopyranose. |  |

II.B. Les polyosides
Généralement, il s’agit de la répétition monotone d’un même ose ou d’un diholoside.
II.B.1. Les polyosides de réserve
II.B.1.a. L'amidon
N’est présent que chez les végétaux. On le retrouve dans les graines, tubercules. Il est stocké dans les amyloplastes en raison de son insolubilité dans l’eau. En chauffant, il donne une solution colloïdale = empois d’amidon.
Il se colore en violet sou l’action de l’eau iodée.
C’est un polymère de maltose qui donne de l’α amylose ou de l’amylopectine.
- l’α amylose
 |
C’est une chaîne non ramifiée d’ α D glucose en liaison (1-4). Elle se présente sous la forme d’une chaîne enroulée en hélice. La molécule est donc compacte et prend peu de place. Elle est bien adaptée à sa fonction de réserve de glucose.
|
- L’amylopectine
C’est un enchaînement de glucose α D (1-4). La chaîne est ramifiée en α(1-6).
 |
 |
Problème : la liaison α(1-6) n’est pas hydrolysable par les amylases. Il reste donc une molécule, la dextrine limite qui va nécessiter une autre enzyme « débranchante » = α(1-6) glucosidase. Quand cette enzyme a agit, l’autre reprend.
L’amylopectine est compacte et bien adaptée à sa fonction de réserve.
II.B.1.b. Le glycogène
C’est un polyoside de réserve. On le trouve dans le foie (10% de la masse du foie), et dans les muscles (1 à 2% de la masse des muscles).
C’est un polymère d’α D glucose en liaison α(1-4). La molécule est beaucoup plus ramifiée que l’amylopectine. On observe une ramification tous les 8 à 12 glucoses. Le glycogène réagit à l’eau iodée en donnant une coloration brune. Les amylases peuvent l’hydrolyser jusqu’à la dextrine limite.
II.B.1.c. Autres polyosides de réserve
- Dextranes. On les retrouve chez les champignons, les levures et les bactéries. Ce sont des chaînes ramifiées, mais la ramification est variable (1-6), (1-2), (1-3), (1-5).
- Inuline. C’est un enchaînement β(1-2) de D fructose. On la retrouve dans les artichauts, le topinambour, les bulbes de dahlias, la chicorée… (règne végétal).
- Xylanes. Ce sont des polymères de xylose.
- Arabinanes. Ce sont des polymères d’arabinose.
- Fructanes. Ce sont des polymères de fructose.
- Mannanes. Ce sont des polymères
II.B.2. Les polyosides de structure
Il sont présents dans la structure cellulaire : parois des bactéries et des cellules végétales, exosquelette des animaux (insectes et crustacés).
II.B.2.a. La cellulose
O β D glucopyranosyl (1-4) β D glucopyranose C’est une chaîne linéaire non ramifiée. C’est une structure linéaire rigide qui permet la formation de liaisons hydrogène. La structure est stabilisée par ces liaisons hydrogène. La structure est bien adaptée à la fonction. Les liaisons hydrogènes se forment entre 2 chaînes voisines. |
 |

Plusieurs chaînes vont se placer côte à côte. Ces molécules sont plus épaisses, insolubles, rigides et non hydrolysables par les α et β amylases. On ne digère pas la cellulose. Très peu d’animaux la digèrent : ruminants et termites grâce à des bactéries. Ces animaux profitent du travail des bactéries. Seul l’escargot semble l’hydrolyser.
II.B.2.b. Les composés pectiques
Ils imprègnent les fibres de cellulose et constituent une matrice entre ces fibres. Ce sont des polymères d’acide D glucuronique ou d’acide D galacturonique.

La fonction acide est estérifiée par les acides aminés. Sinon, elle est liée à des ions, par exemple au Ca2+ divalent. La cohésion des composés pectiques est ainsi assurée.
II.B.2.c. Les hemicelluloses
Polymères de pentoses ou d’autres hexoses (parois végétales).
II.B.2.d. La chitine
On la retrouve dans la carapace des insectes, des crustacés et des parois de champignon. C’est un polymère de N acétyl D glucosamine β(1-4). C’est une molécule linéaire et rigide. |
 |
II.B.2.e. La muréine
C’est un hétéroside (ose + acide aminé). La paroi des bactéries est assimilable à un « mur ». Elle forme autour de la bactérie un grillage maillé.


II.B.2.f. Les mucopolysaccharides
Ce sont des substances acides, parfois associées à des acides aminés (hétéropolysaccharides).
- l’acide hyaluronique est le plus abondant (tissu conjonctif, membranes cellulaires, synovie dans les articulations, humeur vitrée dans l’œil).
- Acide D glucuronique lié β(1-3) N acétyl glucosamine

- La chonchoïtine. N acétyl galactosamine remplace la N acétyl glucosamine. Elle est abondante dans les cartilages.
- L’héparine (cellules des artères, anti-coagulant).
II.B.2.g. Les glycoprotéines
 |
Elles sont très répandues dans les membranes. Leur nature est essentiellement protéique sur laquelle sont fixés des résidus glucidiques (chaînes qui peuvent être ramifiées) . La glycosylation se fait dans le RER ou dans l’appareil de Golgi. Exemple : les glycoprotéines du cell coat. |
Conclusion
Les glucides sont abondants, surtout à cause de l’amidon et de la cellulose. Ces molécules sont très abondantes chez ls végétaux par rapport aux animaux.
Il existe une variété limitée de polyosides qui résultent de la répétition monotone d’un ose ou d’un dérivé, parfois de 2 oses.
Il y a une réelle pauvreté des formes par rapport aux protéines et aux acides nucléiques.
Sujets
- Amidon / cellulose : structures et fonctions.
- La liaison osidique (entre 2 fonctions alcool) α(1-4), β (1-4), β(1-3), β(1-6).
- Les glucides de réserve
- Les hexoses
- Les glucides de structure
- Les pentoses

