Introduction
Terme créé en 1877 qui signifie « dans la levure ». Découle de l’observation de la fermentation alcoolique dont sont responsables les enzymes. Aujourd’hui, on en connaît plus de 2 000.
I. Les caractéristiques générales des enzymes
I.A. Ce sont des biocatalyseurs
I.A.1. Définition d'un catalyseur
Un catalyseur abaisse l’énergie d’activation d’une réaction chimique.

Energie d’activation de la réaction :
| Sans catalyseur : Catalyseur minéral : Enzyme catalase (peroxydase) : |
75 kJ/mol 54 kJ/mol 29 kJ/mol |
I.A.2. Caractéristiques générales d'un catalyseur
Un catalyseur se combine transitoirement au produit initial pour faire baisser l’énergie d’activation. Il augment la vitesse de réaction. Il agit à faible dose. Il se retrouve intact en fin de réaction. Il est incapable de provoquer une réaction thermodynamiquement impossible.
I.A.3. Caractéristiques spécifiques des enzymes
Ce sont des protéines. Elles abaissent très fortement l’énergie d’activation (il faut très peu d’énergie thermique pour déclencher la réaction. Fonctionnement à la température du corps = 37°C). les réactions deviennent compatibles avec la température corporelle.
Exemple de l’hydrolyse de l’amidon :
- HCl = à 100°C, longtemps.
- Enzymes salivaires = à 37°C en quelques minutes.
I.A.4. Spécificité des enzymes
I.A.4.a. Spécificité de réaction
| Une enzyme catalyse une réaction donnée. | |
| Décarboxylase | R-COOH → R-H + CO2 |
| Déshydrogénase | R-H2 + NAD+ → R + NADH + H+ |
| Transaminases |
R1-NH3 + R2 → R1 + R2-NH3 |
I.A.4.b. Spécificité de substrat
|
 |
|
|
|
|
I.B. Les cofacteurs enzymatiques
I.B.1. Les ions métalliques
Ils peuvent être associés à la partie protéique de l’enzyme (partie protéique = apoenzyme) → métallo enzyme.
Ion + partie protéique de l’enzyme = métallo enzyme
Ces ions sont des oligo-éléments (présents à faible dose). Cations = Zn2+, Mg2+, Ca2+, Na+, K+, Fe2+. Ces ions sont fortement lies à l’enzyme. Leur rôle est de :
- Participer à la reconnaissance du substrat
- Participer à la transformation catalytique du substrat
- Stabiliser la conformation tridimensionnelle du site réactif de l’enzyme
I.B.2. Les groupements prosthétiques
Ce sont des cofacteurs enzymatiques non protéiques fortement liés à l’enzyme et indispensables au fonctionnement de celle-ci (selon la classification utilisée, les groupements prosthétiques peuvent être considérés comme des coenzymes : merci à Raph K.Yoyo pour cette précision).
Groupement prosthétique (non π) + apoenzyme (π) → holoenzyme
I.B.3. Les coenzymes
I.B.3.a. Caractéristiques
Ce sont des molécules organiques de petite taille. On en distingue deux sortes sur le plan fonctionnel.
|
|
I.B.3.b. Les principaux coenzymes
- Les coenzymes d’oxydoréduction
Ce sont des transporteurs d’hydrogène (NAD+, NADP+, FAD, FA).
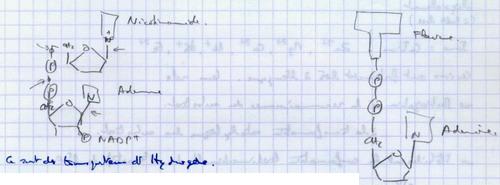
- Les coenzymes de transfert de groupement
| CoεA : transporteur du groupement acéthyl . Il intervient sur le cycle de Krebs. Il a une place centrale dans les lois du métabolisme (catabolisme des glucides, métabolisme des lipides). Le coenzyme A dérive de la vitamine B. |
II. Notions sommaires de cinétique enzymatique
II.A. Déroulement d'une réaction enzymatique
II.A.1. Evolution de la concentration en produit en fonction du temps
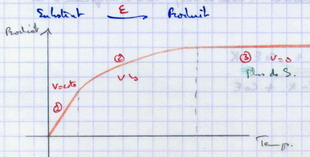
Phase 1 : proportionnalité directe. La vitesse est constante
Phase 2 : La vitesse diminue
Phase 3 : La vitesse = 0
Interprétation :
- Phase 1 : toutes le molécules d’enzyme effectuent le travail de la réaction.
- Phase 2 : les rencontres enzyme – substrat ne sont plus systématiques.
- Phase 3 : il n’y a plus de substrat
II.A.2. Vitesse de la réaction en fonction du temps
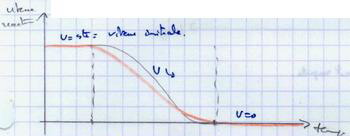
II.B. Influence de la concentration en substrat ou en enzyme sur la réaction
II.B.1. Influence de la concentration en substrat
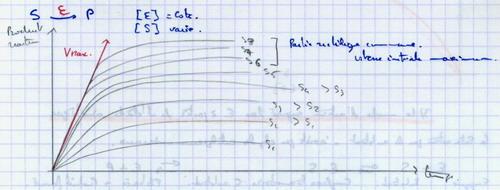
Vmax : toutes les molécules d’enzyme participent à la réaction. Impossibilité d’augmenter la vitesse en ajoutant du substrat. Donc l’enzyme se lie au substrat.
II.B.2. Influence de la concentration en enzyme
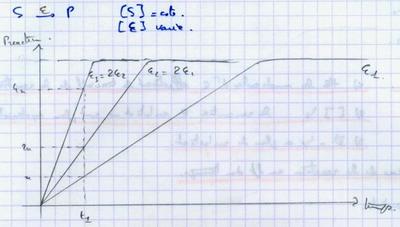
Plus il y a d’enzymes, plus la réaction est rapide.
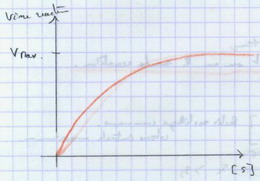
II.B.3. Le mode d'action supposé des enzymes à partir de l'étude cinétique
La saturation par le substrat n’existe pas chez les catalyseurs minéraux.
![]()
II.C. Expression de la vitesse de réaction
II.C.1. Réaction enzymatique - Equation de Mickaelis et Menten
On a recherché une expression de type mathématique qui pourrait donner la vitesse initiale d'une réacation en utilisant des paramètres bien connus.
II.C.1.a. Soit la réaction enzymatique
![]()
La réaction ES ← E + P est considérée comme négligeable :
- d'une part parce qu'on se place en début de réaction quand [P] est très faible
- d'autre part parce que dans les cellules, le produit de la réaction ne s'accumule pas : il est en général utilisé comme substrat d'une autre réaction. On peut donc le négliger
II.C.1.b. Détermination de la vitesse initiale
Vitesse initiale = Vitesse de disparition du compexe ES
Expression la plus simple
| v0 = k+2[ES] | Expression simple, mais [ES] n'est pas accessible à la mesure. Il faut trouver une expression de [ES] à partir de paramètres connus et mesurables. |
Remplacement de [ES] par des paramètres accessibles à la mesure
- Considérons l'expression de la vitesse de formation de ES
| Cette vitesse est fonction de la concentration des produits de départ. | |
| ET : Enzyme totale présente ES : Enzyme liée au substrat ET- ES : Enzyme disponible sous forme libre |
|
| On considère que ES ne se forme pas par réaction retour à partir de E et P | |
- Considérons l'expression de la vitesse de disparition de ES
![]()
- Nouvelle expression de [ES]
A l'état stationnaire, la vitesse de formation de ES est égale à la vitesse de disparition de ES. [ES] = Constante.

Ce rapport est la constante de Mickaelis KM. Il s'exprime en mole/Litre

Nouvelle expression de v0
 |
Cette nouvelle expression ne tient compte que de la quantité initiale de substrat et de la quantité totale d'enzyme et des constantes d'équilibre : tout peut être connu. |
II.C.1.c. Vitesse Maximale
Quand il y a beaucoup de substrat, on atteint la vitesse maximum, et dans ce cas, toute l'enzyme est saturée, et dans ce cas nous aurons [ES] = [ET].
![]()
II.C.1.d. Expression de V0 en fonction de VMax
 |
Cette expression permet de relier vitesse initiale et vitesse maximale. |
II.C.1.e. Valeur de KM

Définition de KM :
| KM = Concentration du Substrat pour laquelle la vitesse de la réaction est égale à ½ de VMax. KM étant une concentration, s'exprime en mole/Litre. | |
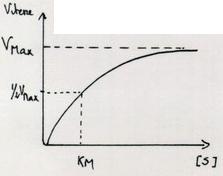 |
On peut calculer KM de façon graphique et expérimentale grace à la courbe de vitesse enfonction de [S]. Intérêt de KM : KM traduit l'affinité de l'enzyme pour son substrat. Plus KM est petit, plus grande est l'affinité de l'enzyme pour le substrat puisque ½ de VMaxest atteint pour de petites [ ] de S. |
II.C.2. Transformation de l'équation de Michaelis
On prend l’inverse de la vitesse en fonction de VMax.


II.D. Influence de divers agents physiques ou chimiques sur la cinétique
II.D.1. Action d'agents physiques
II.D.1.a. La température
 |
|
|
|
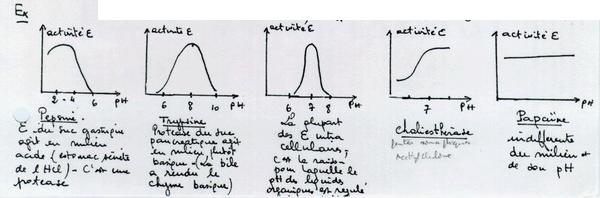
II.D.1.b. Le pH
Il peut agir à 2 niveaux :
- Au niveau de l'enzyme
- en provoquant des modifications d'ionisation de certains groupements fonctionnels dont la charge + ou - est nécessaire à l'action catalytique (ce sont les charges portées par certains radicaux d'acides aminés).
- en provoquant une modification de structure tridimentionnelle qui est une dénaturation
- Au niveau du substrat en changeant son degré d'ionisation ce qui peut empêcher la formation du complexe Enzyme-Substrat.
Le pH optimum est variable d'une enzyme à l'autre et souvent le domaine d'efficacité est assez étroit.

II.D.2. Les inhibiteurs
Ils perturbent fortement le déroulement de la réaction enzymatique. Il existe des inhibiteurs réversibles et irréversibles.
II.D.2.a. Les inhibiteurs compétitifs


Il y a compétition entre l’inhibiteur et le substrat pour le même site enzymatique. C’est une inhibition compétitive. Les formules chimiques sont assez proches, donc les conformations spatiales sont assez proches. C’est aussi une inhibition réversible. La fixation n’est pas irréversible. On arrive à VMax en augmentant la concentration du substrat pour une concentration en inhibiteur fixe.
Applications thérapeutiques contre les infections bactériennes : les médicaments sont des inhibiteurs compétitifs de réactions enzymatiques spécifiques à l’agent pathogène (cas des sulfamides).
II.D.2.b. Les inhibiteurs non compétitifs

Modification de la pente et de l’ordonnée à l’origine. VMax n’est pas atteint, donc une certaine quantité d’enzyme n’est plus disponible.
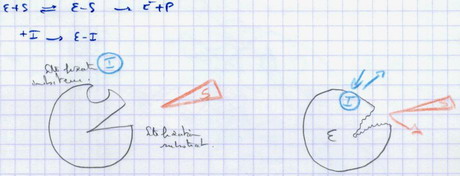
La fixation de l’inhibiteur entraîne une transition allostérique qui modifie la conformation du site de fixation du substrat. Ce dernier ne peut plus se fixer et la réaction n’a pas lieu.
III. Les mécanismes d'action des enzymes
III.A. L'enzyme fixe son substrat au niveau d'un site actif
III.A.1. Arguments en faveur d'une telle idée
- Cinétiques (saturation de l’enzyme par le substrat)
- Spécificité d’action des enzymes (la reconnaissance du substrat nécessite une complémentarité de conformations entre l’enzyme et le substrat)
- Les enzymes ne sont actives que lorsqu’elles possèdent une structure tertiaire bien définie. Si on altère cette structure, l’action enzymatique disparaît.(exemple : ribonucléase)
- Utilisation d’analogues structuraux (molécules qui présentent une conformation 3D très proche de celle du substrat.

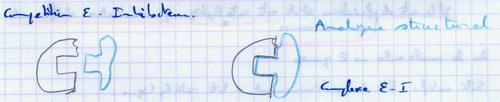
La structure tridimensionnelle confère une structure spécifique au site actif de l’enzyme.
III.A.2. Identification du site actif de l'enzyme
III.A.2.a. Par modification des groupements fonctionnels
Exemple : l’iodoacétate est capable de fixer des groupements sur des sites très actifs. Si on le fait agir sur la ribonucléase, il entraîne une modification de l’histidine 119 et 12. Aucun autre groupement n’est modifié, mais l’enzyme a perdu son activité. Si ces deux groupements ont réagi avec l’iodoacétate, c’est qu’ils sont beaucoup plus réactionnels que les autres histidines de la molécule. Ces deux groupements interfèrent. Le site est-il capable de créer des liaisons avec autre chose ? |
 |
III.A.2.b. Par marquage d'affinité
Il s’agit de faire agir sur l’enzyme une molécule qui ressemble au substrat mais qui va créer des liaisons covalentes fixes et irréversibles avec l’enzyme. On hydrolyse ensuite l’enzyme et on regarde sur quel acide aminé est fixé le substrat.
Exemple : chymotrypsinogène. L’histidine 57 et la sérine 195 peuvent former des liaisons avec de faux substrats. Ces sites réactionnels sont très actifs (grande activité catalytique).
D’une façon générale, on trouve au centre actif des enzymes de l’histidine, de la sérine, et de l’acide glutamique, lysine, arginine.




III.A.3. Le site de fixation / reconnaissance et le site catalytique peuvent être différents
Sur la molécule, ils peuvent être sur deux zones distinctes.
Site actif = site de positionnement + site catalytique
Le site actif est généralement dans une fissure ou un tunnel : la conformation 3D est très importante et peut placer côte à côte des acides aminés très éloignés sur la structure primaire. Ce rapprochement permet l’activité du site, et l’action enzymatique.
III.B. Le site actif induit des réarrangements électroniques permettant l'abaissement de l'énergie d'activation
(c’est à dire permet les réactions) Le site de fixation permet de bien positionner la liaison peptidique face aux acides aminés catalytiques. Il se crée une liaison transitoire car dans les enzymes, il y a des liaisons hydrogènes (liaisons faibles) ∂+ ‑ ∂- qui agissent sur substrat et provoquent un réarrangement électronique entre le substrat et l’enzyme. Les électrons sont attirés, la liaison s’affaiblit, l’énergie d’activation diminue et les liaisons peuvent être plus facilement coupées. Dans l’exemple, la libération du produit permet la fixation d’une molécule d’eau. De nouveau, on assiste à un réarrangement électronique et à la libération du morceau restant. Phénomène : Cette action enzymatique est facilitée par un changement de conformation de l’enzyme après sa liaison avec le substrat (adaptation induite). La fixation du substrat sur l’enzyme entraîne un changement de conformation de l’enzyme qui déforme le substrat. Il se crée alors des tensions sur le substrat et sur les liaisons chimiques. Ce sont des forces physiques dues à la transition allostérique. Les liaisons sont fragilisées et l’énergie d’activation est de ce fait abaissée. Ce phénomène est possible car l’enzyme est >> substrat. |
 |

Dans une cellule, les enzymes ont un fonctionnement régulé. Une réaction ne se produit que si elle est nécessaire. C’est la loi du moindre effort.
IV. La régulation de l'activité enzymatique
Les inhibitions sont-elles des régulations ? Généralement non. Elles peuvent être accidentelles, mais les inhibitions compétitives peuvent exister. Une même enzyme peut agir sur 2 substrats différents. Il existe des enzymes qui sont particulièrement régulées.
IV.A. Les enzymes allostériques
IV.A.1. Les caractéristiques des enzymes allostériques
IV.A.1.a. Situées dans des points stratégiques des chaînes métaboliques

L’enzyme allostérique intervient dans la première réaction de la chaîne.
Exemple d’enzymes allostériques : un des inhibiteurs de la glycolyse est l’ATP. Le blocage de l’étape n°1 permet d’économiser du substrat et de l’énergie. Il évite aussi l’accumulation inutile de produits intermédiaires (loi du moindre effort). L’ADP est un activateur de la glycolyse. La régulation suit un schéma de dualité frein / accélérateur.
IV.A.1.b. Les caractéristiques cinétiques

La réaction demeure très lentement, puis devient explosive. De très faibles variqtions de la concentration du substrat auront des effets métaboliques importants.
IV.A.1.c. Caractéristiques structurales
Les structures quaternaires peuvent former les sous unités des enzymes oligomériques. Si on sépare les sous unités de l’enzyme, on retrouve une cinétique michaëliène (on n’a plus l’effet de coopérativité).
IV.A.2. Mécanismes d'action
IV.A.2.a. L'effet de coopérativité
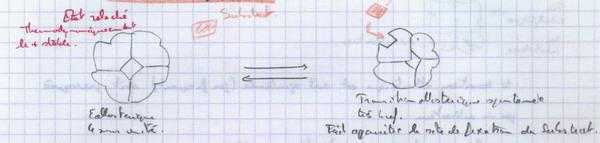
Chaque sous unité est dans sa conformation la plus stable. Elles peuvent changer spontanément de conformation. Ce changement est bref car il ne conduit pas à la structure la plus stable (ces changements sont dus à des chocs, à la température…). Si le substrat se fixe, la sous unité reste dans la conformation transformée et induit le changement brusque des autres sous unités.

Si on sépare les sous unités, on supprime l’effet de coopérativité.
IV.A.2.b. Régulation par des effecteurs

L’activateur va provoquer la transition allostérique de la sous unité permettant l’apparition du site catalytique. Sans activation, il faut attendre une transition spontanée. La réponse est sensible au taux d’activateur. |
 |
La transition allostérique est soit spontanée (peu fréquent), soit provoquée par un activateur (L’ATP est un activateur des pompes membranaires).
IV.B. Les enzymes modulées de façon covalente
Le changement de conformation de la molécule est du à la création d’une liaison covalente avec un groupement (souvent phosphate). Ex. hydrolyse du glycogène :

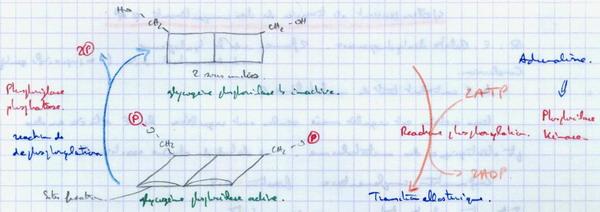
La transition allostérique résulte de la création d’une liaison covalente avec (P). Elles est aussi une enzyme allostérique (effecteurs allostériques qui ne peuvent agir que sur la forme active).
V. Les isoenzymes
V.A. Définition
Ce sont des enzymes qui agissent sur le même substrat pour la même réaction, mais elles existent sous plusieurs formes moléculaires. Exemple : Lactate déhydrogénase.

C’est une enzyme oligomérique formée de 4 chaînes (sous unités) dont deux sont différentes (chaîne A et chaîne B). Les structures AAAA (muscle), AAAB, AABB, ABBB, BBBB (cœur) sont 5 isoenzymes différentes. Leur répartition est différente.
V.B. Caractéristiques
V.B.1. Elles ont une cinétique différente (VMax et kM)
V.B.2. Elles ont une répartition différente dans l'organisme
La régulation au niveau du génome est différente.
V.B.3. Elles répondent à des modulateurs allostériques différents
V.B.4. Elles peuvent se trouver dans des compartiments cellulaires différents
Exemple : la malate déshydrogénase existe sous deux formes, dans le hyaloplasme, et dans les mitochondries (qui possèdent leur propre information génétique).
Conclusion
Les enzymes contrôlent tout le métabolisme cellulaire. Leur action est régulée mais seules sont régulées les enzymes situées en des points stratégiques du métabolisme (en début des chaînes réactionnelles). Il existe une conformation complémentaire entre l’enzyme et son substrat pour permettre la fixation. Les interactions électrostatiques entraînent des réorganisations.


