Alimentation de la plante et rendements
Le règne végétal présente de nombreuses différences avec le règne animal. Les animaux sont en effet caractérisés par un mode de nutrition par ingestion, par l’absence de paroi cellulaire, par le développement d’organes des sens et d’un système nerveux, et par l’aptitude au déplacement. Cette dernière différence est fondamentale. Le végétal est tributaire de son environnement et des conditions climatiques pour assurer sa survie puisqu’il doit trouver son alimentation dans son environnement racinaire direct. L’Evolution a sélectionné les individus présentant de grandes facultés de résistance aux différents stress. Les plantes sont ainsi capables de résister à de grandes variations du milieu extérieur (eau, éléments minéraux, température, lumière…).
| En culture hors sol, les conditions sont différentes. L’objectif n’est plus la survie de la plante mais l’optimisation de sa production. Chacun des stress subis au cours de la culture se traduit par une baisse de rendement, et donc de revenu. Il faut quand même mettre un bémol à cette remarque : les facteurs indispensables à la vie des végétaux ne peuvent pas être considérés sur un pied d’égalité. |  |
Notion de facteur limitant
|
Dans les conditions de culture hors sol, il est possible de hiérarchiser les différents facteurs en fonction des organes considérés. Il en résulte un ordre de raisonnement à respecter pour accroître la production. La composition de la solution nutritive apparaît en fin de liste pour la partie racinaire, derrière l’oxygène et la chaleur. Cette constatation est essentielle. Il est donc possible de s’écarter un peu des équilibres ioniques standards sans affecter le rendement. La composition de la solution nutritive n’est plus figée sur des valeurs arrêtées. Elle peut évoluer à l’intérieur de fourchettes dont l’amplitude reste à définir. |
Critères de choix de la formulation
Il existe un très grand nombre de formules de solutions nutritives, vraisemblablement plus d’une centaine. Certaines sont adaptées à une espèce végétale, d’autres sont plus polyvalentes. La question qui se pose alors à l’utilisateur est la suivante : quelle composition choisir et pourquoi ? En fait, tant qu’un élément ne se trouve pas à une concentration inférieure au seuil de déficience (facteur limitant), il y peu de différences de rendements à partir de solutions présentant une gamme assez large de concentrations.
La raison est assez simple : les racines des végétaux sont adaptées à prélever les éléments minéraux dans des milieux nutritifs très hétérogènes et à des concentrations très variables. Elles sont donc capables d’absorber ces ions à partir d’une solution nutritive dans les mêmes conditions.
D’un autre côté, les impératifs économiques tendent à réduire les apports d’engrais, et donc d’éléments minéraux. Il faut donc trouver une formulation respectant les contraintes suivantes :
- Fournir en quantité suffisante, mais non excessive, tous les macro éléments et oligo-éléments indispensables
- Respecter un équilibre entre les différentes espèces chimiques de manière à éviter tout phénomène d’antagonisme au niveau de l’absorption racinaire
- Respecter les contraintes de la chimie des solutions
- Impacter de manière optimisée les coût d’exploitation
De ce fait, il est hors de question d’utiliser ou de préconiser des formules empiriques. Il est souhaitable de raisonner la composition de la solution nutritive, de l’adapter à l’espèce cultivée et à son cycle de développement.
Notion d'ion
La notion d’ion est le concept fondamental qu’il est impératif de prendre en considération quand on parle de solution nutritive. Les ions proviennent de la dissociation chimique dans l’eau de sels minéraux solides. Ce sont ces entités chimiques, qui n’existent qu’en solution aqueuse, qui sont absorbées par les racines.
En fait, chaque sel minéral introduit dans l’eau se dissocie en donnant une paire d’ions de charge opposée : un ion positif (cation) et un ion négatif (anion). Sous son apparente simplicité, cet énoncé cache la principale difficulté de fabrication des solutions nutritives. En effet, chaque fois que l’on souhaite introduire un élément minéral dans une solution nutritive sous forme de l’un de ses sels, on apporte bien sûr l’ion correspondant, mais aussi un ion associé. Pour les macro éléments, compte tenu des quantités utilisées, il faudra tenir compte de la nature et de la concentration de cet ion associé. Pour les oligo-éléments, ces apports, bien qu’existants sont négligeables en raison de la faiblesse des concentrations.
Ainsi, sans revenir sur les fondements de la chimie, il peut être nécessaire de rappeler quelques notions élémentaires. Quand on dissout du Chlorure de Sodium dans de l’eau, il se forme deux ions de charge opposée :
NaCl ![]() Na+ + Cl-
Na+ + Cl-
Le principal intérêt de l’utilisation des formes ioniques réside dans leur mode d’expression. Leur masse s’exprime par rapport à leur charge en équivalent-gramme (eq) qui s’obtient en divisant la masse atomique de l’élément ou le poids moléculaire de l’entité par la charge de l’ion. Par exemple :
- pour K+, 1 eq = 39,1 / 1 = 39,1 g
- pour Ca2+, 1 eq = 40,02 / 2 = 20,1 g
En raison des concentrations ioniques des solutions nutritives, on utilise un sous multiple au millième de l’équivalent-gramme : le milliéquivalent (meq). Ainsi, 1 eq = 1 000 meq. En exprimant les teneurs des solutions nutritives en équivalent (ou milliéquivalent) d’ion par litre, il est possible d’établir des correspondances entre ces entités chargées. On peut additionner les concentrations des ions de même charge (par exemple la somme des cations K+ + Ca2+ + Mg2+) ou faire la différence entre celles d’ions de charge opposée (équilibre anion-cations).
L’autre conséquence de ces phénomènes de dissociation est que des ions de même nature, mais apportés par des sels différents, se comportent dans la solution nutritive comme des entités chimiques identiques. Par exemple, en introduisant dans un litre d’eau 5 millimoles de KNO3 et 5 millimoles de Ca(NO3)2, on obtient un milieu contenant 15 meq/l d’ions NO3-, 5 meq/l de K+ et 10 meq/l de Ca2+.
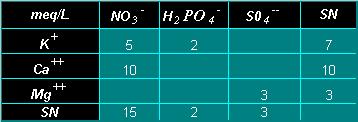 |
La présentation de la composition des solutions nutritives sous forme de tableau à double entrée permet de visualiser les ions, mais aussi les sels dont ils sont issus. Les concentrations en anions sont présentées verticalement, celles en cations horizontalement. Ce système permet de connaître à la fois la concentration de chaque élément et sa forme d’apport dans une Solution Nutritive (SN). Il est aussi possible de vérifier l’équilibre anions-cations de la formulation. |
Détermination de la composition de la formulation
L’approche méthodologique proposée repose sur un principe simple et logique : la solution nutritive doit fournir les éléments minéraux indispensables dans des proportions analogues à celles dans lesquelles elles se trouvent dans le végétal. Plus concrètement, il faut considérer les points suivants :
- L’élaboration de la formulation repose donc sur la composition minérale du végétal choisi qui est déterminée soit par l’analyse chimique, soit à partir des données bibliographiques. A partir ce ces teneurs moyennes en macro éléments et de la mesure de la production de matière végétale, on peut calculer les quantités consommées au cours du cycle de développement. Il est ainsi possible d’adapter la composition de la solution nutritive aux besoins spécifiques de chaque espèce, pour chacun de ses stades de développement.
- La concentration des ions dans la solution nutritive doit, elle aussi, être en rapport avec la consommation hydrique de la plante. Pour cela, on peut mesurer les quantités d’eau absorbées ou utiliser les coefficients de transpiration.
- Enfin, on doit aboutir à une formulation équilibrée entre anions et cations, c'est-à-dire que la somme des anions contenus dans la solution nutritive doit être égale à celle des cations.
La conception de la formulation d’une solution nutritive est encore incomplète si on se réfère uniquement aux besoins en eau et en éléments minéraux indispensables. Il faut aussi faire intervenir d’autres paramètres :
- des facteurs liés au fonctionnement du système racinaire : une bonne connaissance de ces contraintes physiologiques permet de placer le végétal dans des conditions optimales de développement en culture hors sol.
- des données de chimie minérale relatives au comportement des ions aux concentrations utilisées dans les solutions nutritives. Ces contraintes chimiques interviennent sur le choix des produits, sur leurs interactions dans le milieu et sur la disponibilité des ions en solution aqueuse.
Contraintes physiologiques
Le pH est une expression chiffrée qui permet de désigner le caractère acide, neutre ou basique d’une solution aqueuse. La plupart des espèces cultivées se révèlent être tolérantes par rapport à de grandes variations de pH. Cependant, la plage optimale se situe entre 4,9 et 6,5 (soit une fourchette de près de 2 unités pH). La connaissance de cette zone optimum ne présente pas qu’un intérêt physiologique : le maintient du pH des solutions nutritives entre 4,9 et 6,5 permet d’éviter les risques de précipitation des phosphates et sulfates avec le calcium et avec certains oligoéléments.
Compte tenu des variations qu’induisent normalement les racines, il n’y a en général pas lieu de corriger le pH de la solution nutritive des systèmes recyclés au cours de la culture. Cette affirmation peut paraître contradictoire avec l’importance qui est souvent accordée au facteur pH lors de la production de végétaux en culture hors sol. Cette confusion résulte de l’influence de ce paramètre dans certaines pratiques liées aux cultures hors sol :
- Correction de l’eau d’irrigation : lors de la fabrication de la solution nutritive, il est souvent nécessaire de corriger le pH de l’eau d’irrigation quand ce dernier est supérieur à 5,8. Cette opération s’effectue généralement par un apport d’acide nitrique.
- Neutralisation des substrats : l’utilisation de substrats particulièrement acides (tourbe, écorce de pin) nécessite une neutralisation avant emploi. Cette correction est obtenue par addition de chaux ou de carbonate de calcium.
Ayant déterminé les équilibres ioniques entre anions et cations, il faut ensuite fixer la concentration totale d’ions de la solution nutritive. Le raisonnement du rapport optimal entre l’eau et la quantité totale de sels minéraux repose sur les contraintes suivantes :
- la concentration totale en ions doit être suffisamment élevée pour éviter soit de changer la solution nutritive trop souvent (aquiculture), soit de la compléter trop fréquemment (NFT), soit de fournir des volumes trop importants (percolation).
- inversement, la teneur globale en ions (force ionique) ne doit pas être trop élevée, car on risque d’atteindre des valeurs limitantes, voire toxiques pour les racines des végétaux par augmentation de la pression osmotique du milieu.
- enfin, il faut si possible conserver en permanence un rapport équilibré entre la consommation en eau et celle des ions par la racine. Comme ces phénomènes d’absorption varient en permanence, la concentration de chacun des ions doit être suffisamment élevée pour répondre aux besoins de la plante. En effet, dans une culture hydroponique, il n’y a pas de pool de réserve comme c’est le cas, en sol, par l’intermédiaire du complexe argilo-humique.
La concentration en sels (en mg/l) représente la somme de chacun des constituants utilisés dans la formulation. En réalité, ce paramètre est insuffisant pour caractériser une solution nutritive. Il faut plutôt prendre en considération les produits de la dissociation des ces sels, c'est-à-dire la somme des anions et des cations. Cette données, que nous qualifions de force ionique, est mesurée par l’analyse chimique de chacun des ions contenus dans la solution nutritive et exprimée en milliéquivalent par litre (meq/l).
Il existe une technique plus simple pour estimer la force ionique d’une solution saline qui consiste à déterminer sa conductivité électrique. Celle-ci se mesure facilement à partir d’appareils portatifs peu coûteux, mais cette information reste :
- globale, car la conductivité électrique ne fournit aucun renseignement sur les ions présents dans la solution
- imprécise, puisque la réponse de ce paramètre varie avec la nature de l’ion dissous.
Cependant, le contrôle régulier de la conductivité électrique des solutions nutritives est très utile en culture hors sol. Il permet d’évaluer la concentration globale de la solution avant de la fournir aux racine, et surtout d’estimer la consommation des plantes, à partir de mesures effectuées dans les percolats.
En général, une concentration de 20 meq/l de cations et de 20 meq/l d’anions satisfait sans aucun problème l’alimentation hydrique et minérale de la plupart des végétaux. Il faut noter que la réaction des plantes à la salinité varie avec l’espèce, mais évolue aussi en fonction de l’âge et des conditions climatiques.
Dans les solutions nutritives, l’azote peut être apporté sous deux formes :
- l’anion nitrate NO3-
- le cation ammonium NH4+
Compte tenu de la toxicité de l’ion ammonium, il est souhaitable de l’exclure totalement des formulations des solutions nutritives.
Contraintes chimiques
La présence d’ions phosphates joue un rôle fondamental dans la stabilité du pH des solutions nutritives. En effet, l’équilibre entre H2PO4- et HPO42- constitue un système tampon. Son influence se traduit par une limitation de la variation du pH. Si les solutions nutritives ne contenaient pas de phosphates, elles auraient un pH beaucoup moins stable et subiraient donc des variations beaucoup plus fortes lors de l’absorption des éléments minéraux par les racines des plantes.
La deuxième contrainte chimique concerne l’apport d’un oligoélément, le fer. Cet élément se présente sous deux degrés d’oxydation, le fer ferreux et le fer ferrique. Seuls les sels ferreux sont solubles, et c’est sous cette forme que le fer est absorbé par les racines des végétaux. Or, en milieu aqueux, les ions ferreux ont tendance à s’oxyder rapidement pour donner du fer ferrique qui précipite sous forme d’hydroxyde (la rouille) :
Fe2+ ![]() Fe3+
Fe3+ ![]() Fe(OH)3
Fe(OH)3
Au début des cultures hors sol, et pendant près d’un siècle, les formulations utilisaient du sulfate ferreux. Mais, dès qu’il est introduit en milieu liquide, ce sel est oxydé et, dans un délai maximum de 48 heures, les ions ferreux précipitent sous forme d’hydroxyde. Le fer est alors entièrement insolubilisé et donc inutilisable par les racines. Ce problème de stabilité a été résolu par l’utilisation de molécules organiques de synthèse : les chélates. Caractérisés par une très grande affinité pour les ions métalliques, les chélates métalliques sont dotés d’une très grande stabilité en milieu aqueux, et ne libèrent en solution que de très faibles quantités de fer dit libre. L’alimentation en fer des cultures hors sol se fait par le mécanisme suivant : les racines puisent dans la solution nutritive le fer libre avant qu’il ne soit rétrogradé en hydroxyde insoluble. L’équilibre du chélate de fer avec ses constituants se déplace alors vers la libération du fer qui est très lentement relâché dans la solution au fur et à mesure des besoins de la plante. |
 |
Les deux agents chélatants les plus fréquemment employés sont l’EDTA et l’EDDHA. Pour une alimentation en fer convenable, les apports doivent se situer entre 5 et 15 mg de fer métal par litre de solution nutritive.
L’utilisation des solutions nutritives devrait se traduire par la mise à disposition des racines de tous les éléments minéraux sous forme d’ions libres directement assimilables. En réalité, les phénomènes chimiques qui se produisent dans ce milieu aqueux sont beaucoup plus complexes. Les ions, issus de la dissociation des sels dans l’eau, ne se comportent pas de manière totalement indépendante les uns des autres. Ils peuvent se recombiner entre eux pour donner de nouvelles entités chimiques chargées ou neutres, plus ou moins solubles. De plus, même les ions libres peuvent ne pas apparaître totalement disponibles pour les racines en fonction de leur activité ionique. Ainsi, la quantité d’éléments minéraux sous forme de sels ne correspond pas exactement à la quantité d’ions réellement disponible pour le système racinaire. Les applications pratiques de ces considérations théoriques sont les suivantes :
|
|
- La conséquence la plus importante concerne le principe même des formulations. Dans la plupart d’entre elles, la concentration en calcium est plus élevée que celle du potassium (alors que ces proportions sont souvent inversées dans le végétal). Les fondements de cette pratique empirique sont justifiés par la prise en compte des activités ioniques. Par exemple, si l’on veut mettre à la disposition des racines des quantités équivalentes d’ions calcium et potassium, il faudra introduire dans la solution nutritive une concentration supérieure d’ions calcium par rapport aux ions potassium.
Modalités de fabrication de la solutions nutritive
Composition minérale des eaux d’irrigation
Quelle que soit sa provenance (retenue collinaire, cours d’eau, forage…) l’eau se charge en éléments minéraux. Ces derniers proviennent de la plus ou moins grande solubilité des matériaux qu’elle traverse ou qui la contiennent. Il est donc impératif d’en faire l’analyse pour intégrer les résultats dans le calcul de fabrication de la solution nutritive. Trois paramètres doivent être déterminés avec précision :
- les concentrations en éléments minéraux
- le pH
- la quantité d’acide nitrique nécessaire pour ramener à 5,8 le pH d’un litre d’eau d’irrigation (si le pH de l’eau analysée est supérieur à cette valeur)
Fabrication à partir de l’eau d’irrigation
Il faut donc tenir compte des apports d’éléments minéraux contenus dans l’eau utilisée pour fabriquer la solution nutritive. On ne prendra en considération que les ions présents dans l’eau d’irrigation à des concentrations supérieures à 0,1 meq/l. Ces calculs s’appliquent aux seuls macroéléments. Pour les oligo-éléments, les analyses de routine sont destinées à prévenir des phénomènes de toxicité.
Les teneurs en anions et en cations indispensables sont rarement équilibrées dans l’eau d’irrigation (les teneurs totales en anion et en cation sont toujours équilibrées). De ce fait, il n’est que rarement possible d’atteindre la composition théorique de la solution nutritive en ajoutant des sels minéraux dont les teneurs en anions et en cations indispensables sont équilibrées. Il est donc nécessaire d’opérer par ajustements pour obtenir une formulation la plus proche possible de la composition théorique choisie. Le logiciel de formulation des solutions nutritives Vegenut® permet d’automatiser ces étapes de calcul.
Il existe plusieurs méthodes pour introduire les sels minéraux :
- Pesée directe des sels : il s’agit de préparer le volume total de solution choisie en introduisant la quantité de sels pesés les uns après les autres, directement dans l’eau et dans l’ordre suivant : acide nitrique, nitrates, phosphates, sulfate et oligo-éléments. Dans la pratique, cette méthode est à proscrire en raison de la difficulté à dissoudre complètement les sels.
- Solutions Mères : il n’est donc pas souhaitable de dissoudre directement les sels dans l’eau d’irrigation. Mieux vaut utiliser des solutions mères. Il s’agit d’une étape intermédiaire de fabrication de solutions plus concentrées (en général 200 fois pour les macroéléments). Cette pratique permet d’obtenir une dissolution complète de chaque sel, un gain de temps et de volume de stockage, et une meilleure précision des quantités à apporter. En effet, techniquement, à ces concentrations, il est plus facile de mesurer des volumes que de poids. Cette solution concentrée est ensuite diluée 200 fois (soit 5 ml/l) au moment de l’emploi. Le résultat de la dilution des solutions mères dans l’eau d’irrigation est appelé Solution Fille.
Il n’est pas possible de préparer une seule solution mère contenant tous les macroéléments. En effet, à ces concentrations, les ions phosphates et sulfates se combinent au calcium pour former un précipité. Deux types de stations de fertirrigation peuvent alors être utilisées :

- Stations Complètes : une solution mère est préparée pour chacun des sels à apporter. Ces solutions mères sont ensuite diluées successivement dans l’ordre suivant : d’abord l’acide nitrique destiné à la correction du pH (si nécessaire), puis les nitrates de potassium et de calcium, le phosphate monopotassique, le sulfate de magnésium et enfin les oligo-éléments et le chélate de fer. Cette technique est rarement utilisée dans la pratique horticole, en raison de la multiplicité des solutions mères.
- Stations Simples : quelle que soit la formulation, on utilise classiquement un système à deux solutions mères dites A et B permettant de séparer l’apport de Calcium de celui des Sulfates et des Phosphates. L’apport de ces solutions mères s’effectue directement dans l’eau d’irrigation au moyen de pompes volumétriques, dans l’ordre suivant : d’abord la solution A (ou éventuellement la solution d’acide nitrique puis la solution A) et ensuite la solution B. La dilution est à 5 ‰.
 |
Une variante classique de cette méthodologie est d’apporter séparément tout l’acide nitrique pour corriger le pH de la solution fille. Cette méthode s’impose quand l’eau d’irrigation subit des variations rapides de la teneur en carbonates et bicarbonates : il est alors nécessaire de faire varier en conséquence les quantités d’acide nitrique. Dans ce cas, le contrôle du pH et sa régulation sont asservis à une sonde pH. |
La spécificité de l’apport des oligoéléments tient essentiellement aux quantités à fournir aux racines des végétaux qui sont 100 à 1000 fois plus faibles que celles des macroéléments. Il en découle plusieurs conséquences pratiques :
- Bien qu’introduits sous forme de sels (sauf le fer), on ne tiendra pas compte de l’ion d’accompagnement de l’oligoélément car ces quantités sont considérées comme négligeables. Par exemple, si le manganèse, le cuivre et le zinc sont apportés sous forme de forme de sulfates, cet apport en sulfates représente moins de 1 % de l’apport total en sulfate. Ce pourcentage étant inférieur au pourcentage d’erreur sur les opérations de pesée puis de dilution du sulfate de magnésium qui représente la quasi-totalité de l’apport. L’apport en sulfates en tant qu’ion d’accompagnement des oligoéléments n’est donc pas significatif.
- Bien que la plupart de ces éléments soient présents dans la solution sous forme d’ion, les concentrations sont en général exprimées en milligramme d’élément par litre (ppm).
- Tous les oligoéléments, sauf le fer, sont introduits simultanément à partir d’une seule solution mère. A ces concentrations, il n’y a pas de problèmes d’incompatibilité entre les différentes espèces chimiques concernées.
L’apport se fait à l’aide de solutions mères, en général 1000 fois plus concentrées, contenant tous les oligoéléments (excepté le fer). L’horticulteur utilise habituellement des solutions prêtes à l’emploi. Cette pratique est conseillée car elle évite les pesées de faibles quantités, opérations toujours délicates à réaliser et source d’erreurs. Or, la concentration en oligoéléments, si elle est mal contrôlée, peut rapidement devenir toxique.
Etapes de la préparation d'une solutions nutritive
Dans la pratique, la procédure de préparation d’une solution nutritive est la suivante :
- Choix de la formulation adaptée à la culture
- Analyse de la composition minérale de l’eau d’irrigation
- Adaptation de la formulation choisie aux teneurs en éléments minéraux contenus dans cette eau
- Choix de la nature des sels minéraux
- Calcul des pesées de sels correspondants à la fabrication du volume de solution nutritive à préparer (et éventuellement de la quantité d’acide à apporter)
- Fabrication des solutions mères A et B
- Fabrication de la solution fille par dilution des solutions mères dans l’eau d’irrigation
- Contrôle de la composition minérale de la solution fille à la sortie des goutteurs

 Principes de fabrication des Solutions Nutritives
Principes de fabrication des Solutions Nutritives 

